Myosine cardiaque au repos : sa structure enfin révélée !
Pour la première fois au monde, une équipe de l’Institut Curie, a réussi à observer la structure d’une myosine cardiaque dans un état particulier : l’état séquestré. Une découverte qui fait avancer la compréhension du fonctionnement du muscle cardiaque et pourrait avoir des implications pour les patients atteints de cardiomyopathie.
L'équipe fait partie du laboratoire Biologie cellulaire et Cancer (BCC).
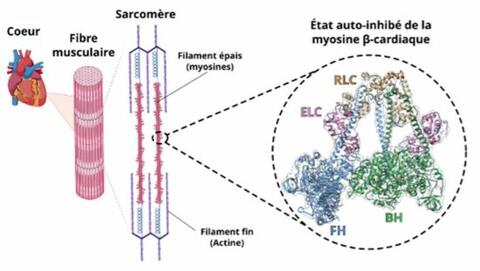
La contraction du muscle cardiaque repose sur la myosine, un moteur moléculaire, qui interagit avec une autre protéine, l’actine. Pour réguler la puissance des contractions du cœur, cet organe ajuste le nombre de moteurs actifs en fonction des besoins. La myosine peut en effet adopter un état « de repos » : l’état séquestré, qui est une structure particulière pour laquelle deux moteurs s’inhibent l’un l’autre. Or personne n’avait jamais vu à quoi ressemblait cet état de près… jusqu’à maintenant. L’équipe « Motilité Structurale » de l’institut Curie en a obtenu une image à haute résolution.
Pour arriver à ce résultat, les chercheurs se sont appuyés sur la cryomicroscopie électronique. Le principe ? Un échantillon de protéines est gelé très rapidement et à très basse température, puis est traversé par un faisceau d’électrons. L’image de chaque protéine peut ainsi être reconstituée individuellement.
"Nous avons sélectionné un échantillon de 200 000 protéines dans toutes les orientations et nous avons fait ensuite des projections pour reconstituer la structure de la protéine en 3D lorsqu’elle est dans son état séquestré", détaille le Dr Julien Robert-Paganin, chargé de recherche CNRS dans l’équipe Motilité Structurale (CNRS UMR144 / Sorbonne Université).
Une meilleure compréhension du muscle cardiaque
Un exploit qui a nécessité l’utilisation des équipements de l’European Synchrotron Radiation Facility, à Grenoble.
"Grâce à cette étude, notre laboratoire est dorénavant formé à cette technique très complexe. Dès que le microscope électronique acquis par l’Institut Curie en février sera opérationnel, nous pourrons l’utiliser pour poursuivre nos recherches sur site" ajoute le Dr Anne Houdusse-Juillé, cheffe de l’équipe Motilité Structurale (CNRS UMR144 / Sorbonne Université).
La découverte de la structure de la myosine cardiaque dans son état séquestré a déjà de grandes conséquences. La première ? Elle apporte des connaissances fondamentales sur le fonctionnement du muscle cardiaque.
"Observer à haute résolution cet état séquestré permet de comprendre qu’il est peu stable, contrairement à celui des myosines du muscle lisse. Ce qui est logique : le muscle cardiaque doit pouvoir moduler ses contractions beaucoup plus rapidement que les muscles du système digestif par exemple." poursuit Julien Robert-Paganin.
Vers des traitements qui stabilisent l’état séquestré
La seconde application est directement médicale : les défauts de contraction du muscle cardiaque sont à l’origine de cardiomyopathies hypertrophiques familiales (CHF), qui touchent environ une personne sur 500.
"Nous savions qu’il existait des mutations sur la myosine cardiaque à l’origine de cette maladie. Mais nous ignorions si elles rendaient les myosines plus actives ou si elles les empêchaient d’atteindre ou de se maintenir dans l’état séquestré. Notre étude montre que cette seconde hypothèse est la bonne. Stabiliser cet état devient donc un objectif thérapeutique et grâce à l’obtention de la structure de la protéine en haute résolution, il va devenir possible de s’en approcher." rappelle Anne Houdusse-Juillé.
Référence
A. Grinzato et al., Cryo-EM structure of the folded-back state of human beta-cardiac myosin, Nature Communications (2023).
